Jak zapisać się na kurs nurkowania!
Kursy nurkowania prowadzimy w Krakowie. Zależy ci na szybkim terminie - skontaktuj się z instruktorem
Tel.: (+48) 501 627 846. lub e-mail. Zawsze możesz zadzwonić i zapytać. Preferujemy kontakt telefoniczny. Więcej.
Jak rzeczywiste gazy
odbiegają od przemiany izotermicznej?
fizyka nurkowania
Przemiana izotermiczna
Przemiana izotermiczna występuje, kiedy temperatura w czasie reakcji nie zmienia się. Jest taka sama przed jak i po reakcji. Równanie gazu doskonałego przyjmuje postać uproszczoną:
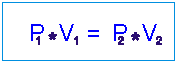
Z tego wzory obliczamy zapas gazy, jaki znajduje się w butlach. Porównajmy wynik otrzymany z obliczeń i z doświadczenia
Obliczenia
Weźmy 2 butle o identycznej pojemności i wykonajmy dwa obliczenia.
- jedną z butli napełniamy do 200 bar,
łączymy z drugą pustą i wyrównujemy ciśnienia. Wyliczmy jakie ciśnienie
powinno być w butlach? Ponieważ objętość butli jest identyczna otrzymamy
wzór P3 = (P1 + P2)/2
Otrzymamy więc P3 = (200 + 0)/2 = 100at - jedną z butli napełniamy do 300 bar,
łączymy z drugą pustą i wyrównujemy ciśnienia. Wyliczmy jakie ciśnienie
powinno być w butlach? Ponieważ objętość butli jest identyczna otrzymamy
wzór P3 = (P1 + P2)/2
Otrzymamy więc P3 = (300 + 0)/2 = 150at
Doświadczenie
Weźmy 2 butle o identycznej pojemności i wykonajmy dwie próby.
- jedną z butli napełniamy do 200 bar, łączymy z drugą pustą i wyrównujemy ciśnienia. Wynik: w obu butlach pozostało po 97 bar.
- jedną z butli napełniamy do 300 bar, łączymy z drugą pustą i wyrównujemy ciśnienia. Wynik: w obu butlach pozostało po 135 bar.
Jak widać obliczenia nie zgadzają się doświadczeniem
Wyjaśnienie
W termodynamice chemicznej 12 rozdział Kalendarza chemicznego rok 55 prof. dr. Bretsznajder i doc. dr. Całus.
W technice często zachodzi potrzeba policzenia własności substancji a w sytuacji
braku odpowiednich tabel można policzyć potrzebne dane w oparciu o teorię
"według której substancje znajdują się w stanach odpowiadających sobie, Gdy
równe są ułamkowe (zredukowane) parametry określające te stany, tzn temperatura
ułamkowa i ułamkowe ciśnienie."
Tr=T/Tc Pr=P/Pc gdzie Tr, Pr wielkości temp. i ciśnienia zredukowanego a Tc , Pc
temp i ciśnienie krytyczne gazu.
Dla gazów H2, He, Ne wzory Tr=T/(Tc+8) Pr=P/(Pc+8) ciśnienia w at temp w K.
Równania Stanu Gazu Rzeczywistego dla 1 mola pV=zRT gdzie z jest współczynnikiem ściśliwości
Wartość podana przez Berthelota z=1+9/128(Pr/Tr)(1-6/Tr*) gdzie *=2
Jak widać jest to funkcja ciśnienia i temperatury. pV=zRT lub zapisane w innej formie pV/z(p,T)=RT a stąd pV/z(p,T)=const.
Dla mieszanin wieloskładnikowych stosujemy parametry pseudokrytyczne, policzone
jako kombinację linową ze współczynnikami równymi molowym ułamkom zawartości
(zawartość procentowa objętościowa) składników.
Po tej porcji wiedzy która służy chemikom do liczenia procesów chemicznych np.
pracy sprężarek do 1000at.
Przechodzimy do nurkowania.
1,03(50) 1,06(100) 1,09(150) 1,12(200) 1,15(250) 1,17(300at) Hel
0,98(50) 0,96(100) 0,98(150) 1,02(200) 1,08(250) 1,14(300at) N2
0,98(50) 0,97(100) 0,96(150) 0,97(200) 0,99(250) 1,02(300at) O2
0,98(50) 0,96(100) 0,97(150) 1,01(200) 1,05(250) 1,10(300at) powietrze
Wykonajmy obliczenia uwzględniając poprawkę na ściśliwość gazów.
0,96(100)/1,01(200)x100at=95at
0,97(150)/1,10(300at)x150at=132at
Podałem współczynniki ściśliwości policzone wg. modelu.
Widać że w 300at wchodzi do butli więcej czynnika oddechowego, dlatego jest to
nieunikniony kierunek rozwoju. (Niektórzy muszą poczekać aż Guru DIR to ogłoszą).
W ten sposób można policzyć dowolne wieloskładnikowe mieszaniny i wiedzieć jak ich zachowanie odbiega od gazu doskonałego.
Dodatkowo dane pokazują bezsensowność stanowiska dyskutantów w temacie blender ??? dla których pomiar ciśnienia dokładnym miernikiem zapewniał wszystko. Jak widać zmiany są większe niż 0,1%.
opracowano na podstawie materiału z forum zamieszczonego przez rc